東ソーは31日、新型コロナウイルス検査試薬の体外診断用医薬品製造販売承認を同日付で取得したと発表した。今後、8月中旬より、医療機関や検査施設向けに販売を開始する予定となっている。
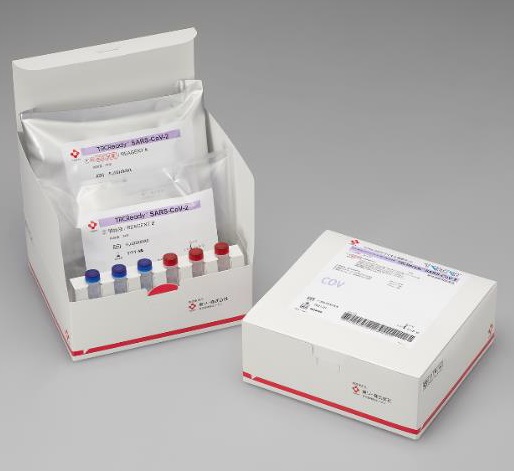
この検査試薬は、同社の既存製品である自動遺伝子検査装置「TRCReady‐80」の専用試薬として、新型コロナウイルスを高感度かつ簡便な操作で、約40分程度で検出することが可能となる。
同社のバイオサイエンス事業の一翼を担う遺伝子検査システムは、「迅速」「簡便」「小型」を特長としている。簡単な前処理(約5分)をした生体試料を装置にセットした後は、全自動で新型コロナウイルスRNAの有無が約40分で判定されるため、検査作業の効率化が可能となり、医療・検査従事者の作業負担を大幅に軽減できる。

さらに、小型装置であることから、より多くの医療機関・検査施設に設置しやすく、新型コロナウイルスの感染拡大防止や検査体制の拡充に貢献することが期待される。
さらに同社は現在、既存製品である全自動化学発光酵素免疫測定装置「ATA‐CLシリーズ」向けの専用試薬として、新型コロナウイルス抗体検査のための試薬の共同開発も進めており、関係機関の協力を仰ぎながら早期の発売を目指す。
東ソーは、ライフサイエンス分野の製品やサービスの提供を通して、人々の健康と福祉に関する社会課題の解決に貢献できるよう、これからも積極的に取り組んでいく考えだ。