カネカはこのほど、新型コロナウイルスの抗原検査キット「カネカ イムノクロマト SARS‐CoV‐2 Ag」の製造販売承認を取得し、体外診断用医薬品として販売を開始した。
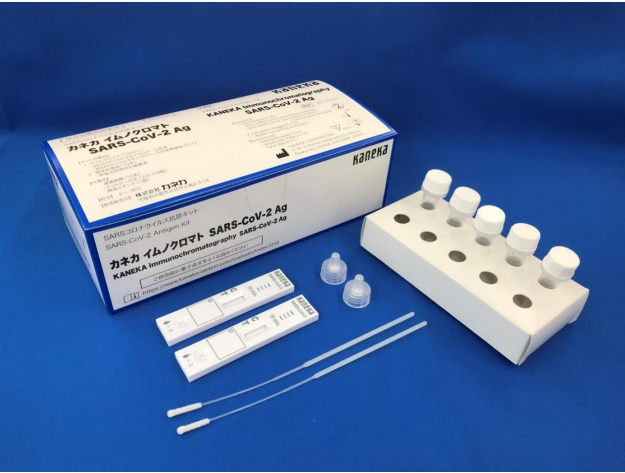
同検査キットは、
2022年6月24日
2021年8月19日
2021年7月5日
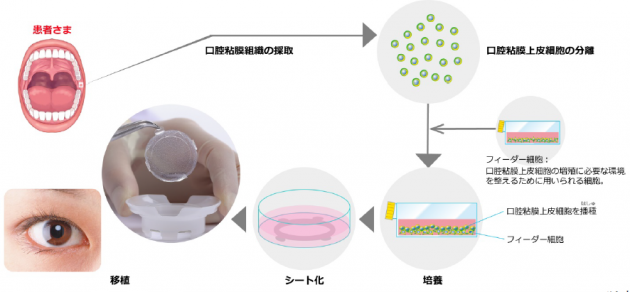
帝人の子会社であるジャパン・ティッシュ・エンジニアリング(J-TEC:愛知県蒲郡市)はこのほど、自家培養口腔粘膜上皮「オキュラル」の製造販売承認を取得したと発表した。
「オキュラル」は、角膜上皮幹細胞疲弊症の治療を目的とした製品で、同疾患に対する口腔粘膜上皮細胞を使った再生医療等製品としては世界初。同製品は、大阪大学大学院医学系研究科の西田幸二教授が開発した技術を導入し実用化した。眼科領域では、昨年3月に製造販売承認を取得した自家培養角膜上皮「ネピック」につづき、国内第2号の再生医療等製品となる。
「オキュラル」は、患者自身の口腔粘膜組織を採取し、分離した細胞を培養して作製するヒト(自己)口腔粘膜由来上皮細胞シート。患者の眼表面に移植することにより、患者自身の口腔粘膜上皮細胞が生着・上皮化し、欠損した角膜上皮の修復を目的としている。角膜上皮幹細胞疲弊症によって両眼の角膜が広範囲に障害を受け、視力が著しく低下した患者に対する新たな治療法として期待される。なお、2020年に角膜上皮幹細胞疲弊症の治療を目的とした希少疾病用再生医療等製品に指定されている。
同社は「ネピック」に加えて「オキュラル」を実用化することで、根治療法の存在しなかった角膜上皮疾患に対する治療法の提供を実現していく。そして既存製品のさらなる販売強化、新規再生医療等製品の開発加速などを通じて、再生医療の産業化を推進するとともに、患者のQOL向上に貢献していく。
2021年6月29日
東洋紡はこのほど、新型コロナウイルス遺伝子検査試薬「TRexGene(ティーレックスジーン)SARS-CoV-2検出キット」について、厚生労働省の製造販売承認を取得したと発表した。7月中にも医療機関と検査施設向けに販売を開始する予定。

同検査キットは、鼻咽頭ぬぐい液や唾液などの生体試料から、リアルタイムPCR装置により新型コロナウイルスのRNAを検出する。検体に含まれる阻害物質の影響を受けにくい反応組成を採用したことで、RNA精製を行うことなく、最短約75分で検体の調製から検出までを行える。昨年8月に発売した新型コロナ検出用キットを基に、体外診断用医薬品として新たに開発した。
同社は、今後もPCR技術を応用し、新型コロナ感染症をはじめ、様々な感染症の検査ニーズに対応する製品の開発に取り組んでいく考えだ。
2021年4月23日
帝人ファーマはこのほど、「オスタバロ皮下注カートリッジ 3mg」(一般名:アバロパラチド酢酸塩)について、骨折の危険性の高い骨粗鬆症を効能・効果として、厚生労働省より製造販売承認を取得したと発表した。なお、同剤は、新医薬品の処方日数制限に対応する製剤を開発中であるため、現時点での上市時期は未定となっている。
同社はこれまで関節領域に関しては、骨粗鬆症治療剤や超音波骨折治療器など、様々なソリューションの提供を通じて、患者のQOL(生活の質)向上に貢献してきた。一方、現在、日本国内の骨粗鬆症の患者数は約1300万人と推定されており、骨粗鬆症に伴い骨折が発生した場合、ADL(日常生活動作)やQOLの低下、生命予後の悪化につながるとされる。そして、特に低骨密度、脆弱性骨折の既往や高齢を伴う「骨折の危険性の高い骨粗鬆症」には、短期間で骨量を増やし、骨折の発生を抑制できる薬剤が求められている。
「オスタバロ」は、ヒト副甲状腺ホルモン関連タンパク質(PTHrP)のN末端から34個のアミノ酸配列のうち、一部を改変したポリペプチドであるアバロパラチド酢酸塩が有効成分。アバロパラチド酢酸塩は、骨代謝に関わる副甲状腺ホルモン一型受容体を選択的に刺激する作用をもち、1日1回の皮下投与により、骨芽細胞の増加を介して骨形成を促進することで、骨量の増加効果が期待できる。
同剤は、骨折の危険性の高い骨粗鬆症の患者を対象とした国内および海外の臨床試験により有効性と安全性が確認されたことから、昨年5月に製造販売承認申請していた。また同剤は、ラディウス・ヘルス社(米国マサチューセッツ州)が、骨折の危険性の高い閉経後女性の骨粗鬆症治療薬として、2017年に米国で承認を取得し販売している。
2020年4月9日
大日本住友製薬はこのほど、非定型抗精神病薬「ラツーダ錠」(一般名:ルラシドン塩酸塩)について、3月25日付で、「統合失調症」および「双極性障害におけるうつ症状の改善」を適応症として、国内での製造販売承認を取得したと発表した。同剤の発売は薬価収載後を予定。
同社は、統合失調症患者を対象とした国際共同フェーズⅢ試験、継続長期試験、双極Ⅰ型障害うつ患者を対象とした国際共同フェーズⅢ試験などの結果を基に、昨年7月に国内の製造販売承認申請を行った。同剤は医薬品事前評価相談実施品目であり、通常よりも短い約8ヵ月の審査期間で承認を取得した。
同剤は、同社が創製した独自の化学構造を持つ非定型抗精神病薬。2010年に米国で成人の統合失調症に係る効能・効果で承認されて以降、今年3月現在、統合失調症に係る効能・効果では欧米を含む47の国・地域で承認されており、双極Ⅰ型障害うつに係る効能・効果では米国を含む7つの国・地域で承認されている。同剤は海外のガイドラインで体重増加リスクが低いとされる抗精神病薬であり、双極性障害のうつ症状では第1選択薬の1つとして推奨されるなど、治療選択肢が少ない当該治療に貢献している。
同社は、今回の承認取得により、統合失調症および双極性障害でのうつ症状の新たな治療選択肢を提供することで、国内の両疾患治療に貢献できるものと期待している。
2019年4月1日
帝人ファーマはこのほど、アデノシンデアミナーゼ(ADA)欠損症治療剤「レブコビ筋注2.4㎎」=一般名:エラペグアデマーゼ(遺伝子組み換え)=が同日、厚生労働省から製造販売承認を取得したと発表した。
同剤については、英国の製薬企業であるリーディアント社と、日本での独占開発・販売契約を締結している。なお、同剤は、2016年3月に同省から希少疾病用医薬品に指定されている。
ADA欠損症は、遺伝子の変異が原因でADAという酵素の欠損や機能低下が生じることにより、血液中のリンパ球が減少し、重症免疫不全などを引き起こす疾患で、難病にも指定されている。発症頻度が20万~100万人に1人という希少疾病で、重症感染症により1歳前後までに死亡するケースも少なくない。
治療としては、造血幹細胞移植が第1選択となっており、その他の療法として、ADAを注射で投与することで免疫機能の改善を図る酵素補充療法や、遺伝子治療が行われている。しかし、これまで日本では酵素補充療法に用いるADA製剤が承認されておらず、それが治療上の課題となっていた。
こうした中、厚生労働省の「医療上の必要性の高い未承認薬・適応外薬検討会議」で、ADA酵素補充製剤の開発企業の募集が行われたのを受けて、帝人ファーマは2014年にリーディアント社(当時の社名はシグマ・タウ・ファルマ社)と、日本での独占開発・販売契約を締結し、ADA欠損症の新たな治療選択肢の提供を目指して開発に着手。帝人ファーマが日本国内で実施した第Ⅲ相試験と、リーディアント社が米国で実施した第Ⅲ相試験の結果に基づき、昨年6月に承認申請を行っていた。