デンカは28日、米国Xtrava Health社と提携し、新型コロナウイルス抗原迅速診断キット「クイックナビ-COVID19 Ag」を、「SPERA COVID19 Ag Test」としてXtrava社に供給すると発表した。
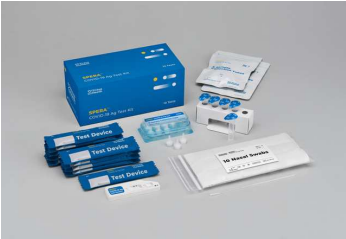
米国では新型コロナ感染拡大防止に向けた緊急政策の下で、医療機関だけでなく介護・教育施設や自宅などでの検査体制の拡充が検討されている。集団スクリーニングテストの対象範囲拡大や検査頻度の増加などにより今後検査需要がさらに増えると予測されることから、迅速かつ簡易に使用できるデンカの抗原迅速診断キットを供給し、米国市場に本格参入する。
Xtrava社は「SPERA」の発売実現に向けて、今年3月に米国国立衛生研究所(NIH)とRADxに基づく契約を締結。現在、Xtrava社はPOCT(Point of Care Testing)用として米国食品医薬品局(FDA)緊急使用許可取得を目指して臨床試験を進めており、今年後半の販売を目標にしている。

デンカの抗原迅速診断キットと、Xtrava社のリーダーで診断キットの結果を読み取る「コンパニオン・デジタル・テスト・プラットフォーム」を組み合わせることで、感度や使い勝手、検査精度向上を図り、一般の人々にも簡易に扱えるように、OTC(処方箋がなくても店頭で購入できる医薬品)市場への導入を目指していく。