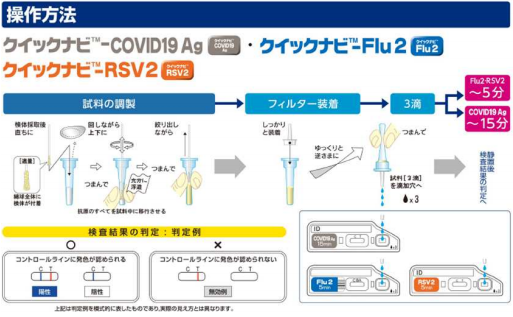
デンカはこのほど、医療従事者の感染リスク低減と受診者の負担軽減のため、新型コロナウイルス抗原迅速診断キット「クイックナビ‐COVID19 Ag」について検体種を追加する製造販売承認事項一部変更承認を厚生労働省より受けたと発表した。
今回の承認により、同診断キットは、従来の鼻咽頭ぬぐい液(鼻の奥で採取した検体)に加えて、鼻腔ぬぐい液(鼻孔から2㎝程度スワブを挿入して採取した検体)による検査ができ、さらに、医療従事者の管理下での受診者による検体採取が可能となった。
これにより、医療従事者の感染リスクが低減され、受診者の負担も軽減される。また、インフルエンザなどの流行に備え、1度の検体採取で同迅速診断キットとインフルエンザ抗原迅速診断キット「クイックナビ‐Flu2」やRSウイルス抗原迅速診断キット「クイックナビ‐RSV2」を同時に検査することが可能となっている。
同社では抗原検査のさらなる普及に向け、検査感度の向上、判定時間の短縮など「クイックナビ‐COVID19 Ag」の性能や利便性を高めるとともに、インフルエンザウイルスと新型コロナウイルスを同時検出するコンビキットの開発など、より使いやすい検査キットの提供を目指していく。