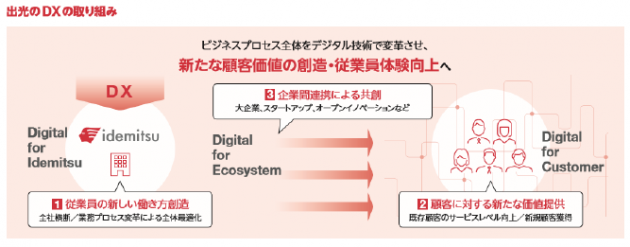
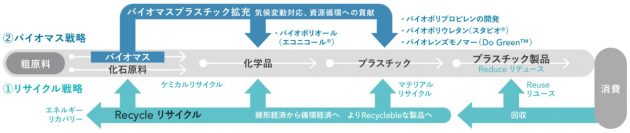
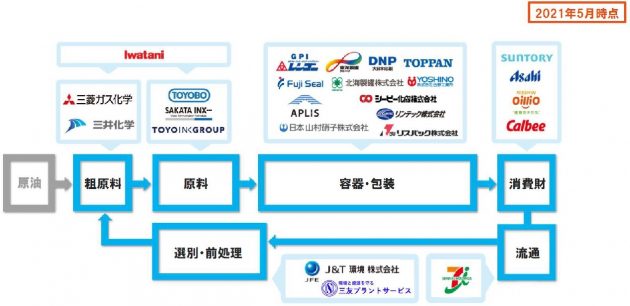
出光興産とIHIは25日、出光興産徳山事業所(山口県周南市)で行う、アンモニアサプライチェーン(SC)構築に向けた検討に共同で取り組むことに合意したと発表した。今回の合意の下、貯蔵施設・石化装置などの既存設備を活用した、徳山事業所のアンモニア輸入基地化、ナフサ分解炉などでのアンモニア混焼実証を検討する。また、出光興産は海外からのブルー・グリーンアンモニアの輸入や、コンビナート近隣事業所へのアンモニア供給を検討する。
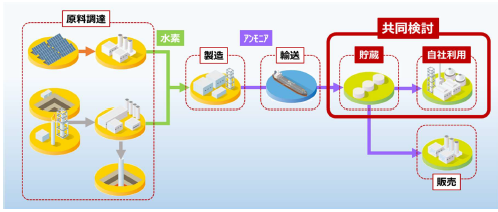 アンモニアサプライチェーンのイメージと共同検討範囲
アンモニアサプライチェーンのイメージと共同検討範囲
日本政府が2050年カーボンニュートラル(CN)を宣言する中、その具体策の1つとして水素・アンモニアによる水素キャリア・チェーン実現に向けた官民による取り組みが加速。製造時に排出されるCO2を回収・貯留したブルーアンモニアや、再生可能エネルギーを利用したグリーンアンモニアの製造については、海外でも調査・検討が開始されている。輸入基地をはじめとした商業規模のSC構築のための施設整備には中長期的な視点での検討が必要であり、より効率的に早期の実証を行うことが求められている。
出光興産は、昨年度、国土交通省のCNポート検討会に徳山事業所やグループ製油所が参画するなど、水素・アンモニアSC構築に向けた検討を進めるとともに、海外からのブルー・グリーンアンモニア調達に向けた他社との協業を検討してきた。中でも徳山事業所は、従来比約30%の省エネルギー効果を発揮できる高効率ナフサ分解炉の稼働を今年1月に開始し、さらに来年に稼働予定のバイオマス発電所の建設など、脱炭素に向けた取り組みを加速させている。これらの取り組みは、石油精製事業で従来使用していたインフラを活用することで効率的に実現している。
一方、IHIは、発電設備の燃料として石炭や天然ガスとアンモニアを混焼する技術開発で世界をリードしている。これまでに2千kW級ガスタービンでは、液体アンモニアの70%混焼を世界で初めて達成していることに加え、今後、商用石炭火力発電所を対象としたアンモニア混焼の実証試験を行う予定。また、燃料アンモニアの社会実装を見据えて、国内外でアンモニアSC構築に向けた検討を進めている。
両社は、これまでも徳山事業所の貯蔵設備などについて協業関係にあった。今回の合意により、出光興産は、徳山事業所の既存インフラ設備を生かし、アンモニアSC実証の検討や国内での許認可などの取得を行う。IHIは、アンモニア貯蔵・燃焼技術を活用し、アンモニア貯蔵設備・入出荷設備やアンモニア燃焼実証を検討する。両社の強みを生かし、世界的にも先進的なアンモニアSCを早期に実現することで、CN社会の実現に貢献していく。